Ketogeeninen ruokavalio syövän terapiana
Hae-Yun Chung, Yoo Kyoung Park
Disclaimer
Ketogeeninen ruokavalio ei ole maaginen enkelihoito, joka parantaa kaikki sairaudet. Sen terapeuttinen hyöty perustuu siihen, että KD minimoi sokereiden tarpeen käyttämällä sokerin sijaan rasvaa energian ensisijaisena lähteenä. Kroonisesti korkea verensokeri ja veren korkea insuliinipitoisuus altistavat monille sairauksille. Hiilihydraattien rajoittaminen auttaa elimistöä korjaamaan korkeiden sokeri- ja insuliinipitoisuuksien aiheuttamia vaurioita.
En väitä, että ketogeeninen ruokavalio parantaa syövän. Sellainen väite olisi julkeaa liioittelua, koska parantumisesta ei voi antaa takeita. Tutkimusten perusteella on vahvaa näyttöä siitä, että ketogeeninen ruokavalio parantaa syövän ennustetta. Ketogeeninen ruokavalio hidastaa syöpäsolujen kasvua ja lisääntymistä. Se vahvistaa immuunijärjestelmää, tehostaa aineenvaihduntaa ja hillitsee matala-asteista tulehdusta.
Ketogeenisen ruokavalion metaboliset hyödyt syöpien ja monien muiden sairauksien terapiana on laajasti tunnustettu ja osoitettu useissa tutkimuksissa. Tieteellinen näyttö ketogeenisen ruokavalion metabolisista hyödyistä lisääntyy jatkuvasti. Avaan joitain aihetta käsitteleviä tutkimuksia ja selitän, mihin ketogeenisen ruokavalion terapeuttiset hyödyt perustuvat. Ketogeenistä ruokavaliota on käytetty vuosisadan ajan lääkeresistentin epilepsian kohtausten ehkäisyyn. Hiljattain saatiin näyttöä, jonka mukaan niukasti hiilihydraatteja sisältävä ketogeeninen ruokavalio voi toimia lääkehoitoja vahvistavana terapiana Alzheimerin ja Parkinsonin tautien sekä eräiden syöpien hoidossa.
Ketogeeninen ruokavalio vaikuttaa selektiivisesti syöpäsolujen näännyttämiseen estämällä niiden glukoosin ottoa, vaikuttamalla mTOR-signalointireittiin ja sotkemalla pahanlaatuisten solujen energiametaboliaa.
Ketogeenisen ruokavalion mahdollisia terapeuttisia etuja:
-
hillitsee matala-asteista tulehdusta ja oksidatiivista stressiä
-
vahvistaa immuunijärjestelmää
-
tehostaa aineenvaihduntaa ja solujen sisäistä signalointia
-
lisää kehon antioksidanttien, kuten superoksidaasidismutaasin tuotantoa
-
laihduttaa tehokkaasti; lihavuus on syöpien itsenäinen riskitekijä
-
laskee veren sokeri- ja insuliinipitoisuutta
-
parantaa veren lipidiarvoja
-
lisää solujen insuliinisensitiivisyyttä ja vähentää insuliiniresistenssiä
-
lisää glutamaatin synteesiä GABA:ksi
-
vähentää stressihormoni kortisolia
-
muttaa elimistön metabolian sokeripolttoisesta rasvapolttoiseksi
-
käynnistää soluja puhdistavan ja kuona-aineita kierrättävän autofagian
-
syöpäsolut ovat riippuvaisia glukoosista ja glutamiinista
-
tuumorisolut eivät saa energiaa ketoaineista tai vapaista rasvahapoista
-
KD estää mTOR signalointireitin
-
hillitsee insuliinin kaltaisen kasvutekijän (IGF 1) tuotantoa
Syöpäsolut tarvitsevat ravinnoksi glukoosia ja/tai glutamiinia
Ketogeenisen ruokavalion tarkoitus on näännyttää syöpäsoluja nälkään. Ajatus on, että syöpäsolut eivät elä ilman glukoosia tai glutamiinia, eivätkä voi käyttää ketoaineita ja vapaita rasvahappoja energian tuotantoon, kuten melkein kaikki elimistön terveet solut.
Puutteellinen ravinnonsaanti hillitsee ketogeenisellä ruokavaliolla syöpäsolujen aggressiivista kasvua ja lisääntymistä. Ketogeenisen ruokavalion noudattaminen ei kuitenkaan todennäköisesti paranna syöpää. Se voi hidastaa syövän pahenemista eräiden metaboliareittien välityksellä.
Ravintoon perustuvat terapiat kompastuvat herkästi siihen, että syöpäsolut osaavat tuottaa energiaa glukoosin lisäksi myös glutamiinista, joka on eräs yleisimmistä aminohapoista. Pelkkä sokereiden saannin rajoittaminen ei riitä tukahduttamaan syöpäsoluja.
Glutamiinia saa monista arkisista ravintoaineista (liha, kala, munat, monet raa’at vihannekset, palkokasvit jne,..). Glutamiini ei kestä kypsennystä, joten kypsennetyt ruoat eivät juurikaan lisää kehon glutamiinitasoja, mutta koska keho tarvitsee glutamiinia, se valmistaa sitä itse.
Glutamiini on määrällisesti kehon yleisin aminohappo. Elimistö käyttää sitä mm. lihaskunnon ylläpitämiseen. Glutamiini voi toimia glukoneogeneesin lähtöaineena ja solujen polttoaineena. Glutamiini myös ylläpitää suoliston terveyttä ja nopeuttaa lihasten palautumista rasituksesta.
Jos soluille tarjotaan energian lähteiksi ketoaineita ja vapaita rasvahappoja, glutamiinin synteesin tarve todennäköisesti vähenee. Tämä voi olla yksi syöpäsolujen kasvua ja leviämistä hillitsevä mekanismi.
Solut osaavat valmistaa glutamiinia mm. glutamaatista ja ammoniakista. Ketogeeninen ruokavalio lisää glutamaatin synteesiä gamma-aminovoihapoksi (GABA), mikä teoriassa voisi vähentää glutamaatin biosynteesiä syöpäsoluja ruokkivaksi glutamiiniksi.
Hermostoa rauhoittava gamma-aminovoihappo on hormoni ja glutamaatin vastavaikuttaja. Ketogeeninen ruokavalio laskee stressihormoni kortisolin eritystä. Myös tämä metabolinen reitti voi tuottaa myönteisen vasteen kamppailussa syöpäsoluja vastaan. Solutasolla KD lisää elimistön valmistamien antioksidanttin, kuten superoksidaasidismutaasin tuotantoa. Tämä voi vaimentaa syövän leviämiselle otollista matala-asteista tulehdusta ja oksidatiivista stressiä.
Lähes kaikki terveet solut veren punasoluja paitsi voivat hyödyntää ketoaineita ja/tai vapaita rasvahappoja energianlähteenä. Tuumorisolut saavat energiaa vain glukoosista ja glutamiinista.
Veren glukoosipitoisuuden laskiessa haiman erittämän insuliinin pitoisuus verenkierrossa vähenee. Insuliini on elimistölle välttämätön anabolinen hormoni, mutta korkea insuliinipitoisuus eli hyperinsulinemia assosioituu vahvasti moniin sairauksiin, kuten sydän- ja verisuonitauteihin, aikuistyypin diabetekseen sekä syöpiin (tutkimuksia insuliinin ja syövän yhteydestä: a, b, c, d, e). On näyttöä siitä, että syöpäsolut voivat valjastaa insuliinin kuljettamaan niille energiaa.
”Endogenous hyperinsulinemia has been proposed as one of the causal factors contributing to the association between obesity, diabetes, and increased cancer risk and mortality. Previous studies have examined the mechanisms through which hyperinsulinemia promotes cancer progression, but it is not understood how hyperinsulinemia contributes to cancer incidence. Disruption of cell polarity is an early event in epithelial cancers, and cells that lose polarity are usually eliminated through tumor-suppressive cell competition. Sanaki and colleagues used Drosophila with scrib (scribble planar cell polarity protein) mutant cell clones in the eye disc to understand the mechanisms underlying tumor-suppressive cell competition. They discovered that hyperinsulinemia gives epithelial cancer cells a competitive advantage. – Hyperinsulinemia and insulin receptor signaling allow cancer cells to evade cell competition.”
Glukagoni ja katabolinen aineenvaihdunta
Rasvaan perustuva ketogeeninen aineenvaihdunta lisää glukagonin (katabolinen hormoni) eritystä. Glukagonia erittyy haiman alfasoluista verensokerin laskiessa.
Yksinkertaistettuna anabolinen (insuliinin ohjaama) aineenvaihdunta rakentaa yksinkertaisemmista molekyyleistä monimutkaisempia molekyylirakenteita (proteiineja, sokerivarastoja ja rasvakudosta), kun katabolinen aineenvaihdunta puolestaan purkaa monimutkaisempia molekyylejä yksinkertaisemmiksi. Insuliini ja insuliinin kaltainen kasvutekijä 1 vaikuttavat syöpään.
Glukagoni purkaa sokeri- ja rasvavarastoja energiakäyttöön. Glykogeenien tyhjennyttyä lipolyyttiset hormonit alkavat purkaa rasvasolujen sisältämiä triglyseridejä energiakäyttöön.
Glukagoni saa aineenvaihdunnan purkamaan ja polttamaan varastoitua energiaa (läskiä). Muiden lipolyyttisten hormonien kanssa glukagoni käynnistää rasvasolujen lipogeneesiin, jossa triglyseridit puretaan vapaiksi rasvahapoiksi ja glyseroliksi verenkiertoon. Niistä elimistö voi tuottaa energiaa (betaoksidaatio) ja energiaravinteita (ketogeneesi ja glukoneogeneesi).
Rasvakudos toimii kuin itsenäinen elin vaikuttamalla kylläisyyshormoni leptiinin erityksen lisäksi tulehduksellisten sytokiinien eritykseen, mikä ylläpitää syövälle otollista matala-asteista tulehdusta.
Lihavuus on itsenäinen syövälle altistava riskitekijä, joka lisää syöpäkuolleisuutta. Matala-asteista tulehdusta ylläpitävän rasvakerroksen haihduttaminen ketogeenisellä ruokavaliolla laihduttaa, parantaa veren rasva- ja sokeriarvoja sekä verenpainetta. KD lisää solujen insuliinisensitiivisyyttä, hillitsee matala-asteista tulehdusta ja oksidatiivista stressiä. Insuliiniresistenssi auttaaa syöpäsoluja kaappaamaan verestä glukoosia.
Näiltä osin on runsaasti hyvin perusteltua ja uskottavaa evidenssiä, että ketogeeninen ruokavalio voi parantaa syövän ennustetta.
Hiilihydraattien saannin rajoittamisella glukoosin määrää ei voi täysin nollata, koska elimistö tarvitsee glukoosia ja valmistaa sitä tarpeen mukaan glukoneogeneesissä itse mm. veren punasoluille. Elimistö tarvitsee myös glutamiinia, jota solut valmistavat tarvittaessa.
Kaikki eivät kuitenkaan ketogeenisen ruokavalion hyötyihin usko. Osa tutkijoista suhtautuu ketogeeniseen ruokavalioon hyvin kriittisesti. He perustelevat kriittistä kantaansa sillä, että ketogeeninen ruokavalio voi laukaista ja ylläpitää kakeksiaa, eli sairaalloista laihtumista. Tästä syystä ruokavalioterapian aloittamisesta on hyvä keskustella hoitavien lääkäreiden ja onkologien kanssa.
Kakeksia tarkoittaa vaikeasta sairaudesta tai ravinnon puutteesta aiheutuvaa kuihtumista, väsymistä, lihaskudoskatoa, vaikeaa aliravitsemusta ja laihtumista. Mahdollisia tilaan johtavia sairauksia ovat krooniset infektiot ja syövät.
Tämän tutkimuskatsauksen aineistoon on koottu vuosien 1985 ja 2017 välillä tehtyjä kontrolloituja ihmistutkimuksia. Tutkimuskatsauksessa analysoitiin 10 kriteerit täyttävää tutkimuspaperia. Katsaus koottiin syöpäpotilaiden ihmiskokeiden tuloksista ja se tarkasteli ketogeenisen ruokavalion käyttökelpoisuutta syöpäpotilaiden hoitoa tehostavana ravintoterapiana.
Tulokset osoittivat potilaiden painon ja antropometristen muutosten sekä seerumin veriprofiilien paranemista. Ketogeenisellä ruokavaliolla elimistön laktaattipitoisuus laski. Merkittäviä muutoksia potilaiden elämänlaatua arvioivissa mittauksissa ei raportoitu.
Ketogeeninen ruokavalio on muita onkologisia hoitoja tehostava terapiavaihtoehto tietyissä syövän alatyypeissä, joiden tulokset näyttävät korreloivan elimistön metabolisen tilan kanssa, mutta tulokset eivät ole aivan kiistattomia ja johdonmukaisia. Siksi tämä aihe edellyttää lisätutkimuksia.
Johdanto
Ruokavalioon ja liikuntaan perustuvat interventiot ovat hyödyllisiä syöpään ja sen hoitoon liittyvien haittatapahtumien lieventämisessä. Ruokavalio- ja liikuntainterventiot näyttävät lisäävän syöpään sairastuneen odotettavissa olevaa elinaikaa [3].
Syövän aineenvaihduntaprosessit ovat monimutkaisia ja hyvin säänneltyjä. On yhä enemmän todisteita siitä, että ruokavalion mukauttamisesta voi olla runsaasti hyötyä hoidettaessa syöpää.
Runsaasti rasvaa, maltillisesti proteiineja ja niukasti hiilihydraatteja sisältävä ruokavalio [4] tai energiaa rajoittava ruokavalio [5,6] tehostavat syöpään sairastuneen hoitoa. Ketogeeniseen ruokavalioon perustuva pätkäpaasto sekä niukkaenerginen ketogeeninen ruokavalio vaikuttavat hidastavan tehokkaasti syövän leviämistä. Joidenkin tutkimusten mukaan paasto ja pätkäpaasto ehkäisevät tehokkaasti syövän kehittymistä.
Kalorirajoituksen on havaittu vähentävän kasvua edistävää signalointia laskemalla väliaikaisesti glukoosipitoisuutta ja hillitsemällä insuliinin kaltaista kasvutekijää 1 (IGF 1), joka assosioituu vahvasti ikääntymiseen ja syöpään [7].
Molekyylireittien manipulointi kalorirajoituksella tehostaa syöpäsolujen altistumista sytotoksiselle sädehoidolle ja kemoterapialle muun muassa rintasyövän hoidossa. Monet syöpäpotilaat eivät kuitenkaan jaksa noudattaa kaloreiden rajoittamista.
Perinteinen ketogeeninen ruokavalio ei rajoita ravinnosta saatavan energian määrää. Viime aikoina hyvin vähäkalorisen ketogeenisen ruokavalion (VLCKD) ja niukasti hiilihydraatteja sisältävän pätkäpaaston noudattamisen terveyshyödyistä on saatu paljon uutta tietoa. Ketogeenisen ruokavalion tarkoitus on käynnistää energianlähteiksi kelpaavien ketoaineiden (asetoasetaatin, asetonin ja betahydroksibutyraatin) tuotanto ketogeneesissä.
Niukka energiansaanti ja ketoosi käynnistävät solujen puhdistus- ja kierrätysjärjestelmän, eli autofagian. Autofagia tehostaa solujen energiansaantia ja terveyttä kierrättämällä soluihin kerääntyneitä kuona-aineita, kuten vaurioituneita ja keskeneräisiä proteiiniketjuja energiaksi ja uusiksi soluelimiksi. Autofagiaa tutkitaan syövän hoitona.
Ketoosin käynnistämisen tarkoituksena on vähentää syöpäsolujen tarvitseman glukoosin määrää elimistössä tuottamalla elimistön terveille soluille energiaksi kelpaavia ketoaineita ja vapaita rasvahappoja, joita syöpäsolut eivät voi käyttää energianlähteinä.
Vander Heiden et al. [8] havaitsivat, että pahanlaatuiset kasvaimet käyttävät huomattavan suuria määriä glukoosia ympäröivään kudokseen verrattuna ja tuottavat lopulta laktaattia aerobisen glykolyyttisen reitin kautta.
Glukoosin saatavuuden rajoittaminen voi vähentää syöpäsolujen energiantuotantoa ja siten hidastaa syövän leviämistä [9].
Tapaus glutamiini
Aminohappo glutamiini on vähemmän tunnettu ravintoaine, joka vaikuttaa syöpäsolujen kasvuun.
Glutamiini on ehdollisesti välttämätön aminohappo, jota käytetään laajalti ravintolisänä, erityisesti sen immunomoduloivan roolin vuoksi. Glutamiinilla on useita biologisia toimintoja, kuten solujen lisääntyminen, energiantuotanto, glykogeneesi, ammoniakkipuskurointi ja happo-emästasapainon ylläpito.
Glutamiini ehkäisee lihassolujen väsymistä. Tärkeimmät väsymyksen syyt ovat: protonien kertyminen lihassoluihin, energialähteiden (esim. Fosfokreatiinin ja glykogeenin) ehtyminen, ammoniakin kertyminen vereen ja kudoksiin, oksidatiivinen stressi, lihasvauriot ja muutokset välittäjäaineiden synteesissä, kuten serotoniinin lisääntyminen ja dopamiinin väheneminen.
Glutamiini voi viivästyttää väsymystä useilla mekanismeilla: (i) se on yksi yleisimpiä glykogeenisiä aminohappoja, jolla on merkittävä vaikutus sitruunahappokierron anapleroosiin ja glukoneogeneesiin, (ii) glykogeenisyntaasin aktivaatio (glutamiinia pidetään glykogeenisynteesin suorana stimulaattorina), (iii) glutamiini on tärkein myrkytön ammoniakkipuskuri (se sitoo ammoniakkia) välttäen tämän metaboliitin kertymistä, (iv) glutamiini liittyy myös lihasvaurioiden korjaamiseen ja sitä pidetään epäsuorana antioksidanttina muun muassa stimuloimalla glutationisynteesiä.
Vuonna 1955 Harry Eagle teki yllättävän löydön laboratoriossa kasvatetuista syöpäsoluista. Hän havaitsi, että syöpäsolut tarvitsivat hyvin suuria määriä glutamiinia. Ilman glutamiinia syöpäsolut lopettivat kasvun ja lopulta kuolivat huolimatta kaikista muista syöpäsoluihin vaikuttavista tunnetuista tekijöistä.
Glutamiini on aminohappo. Se on yksi kahdestakymmenestä molekyylistä, joista solut kokoavat proteiineja. Glutamiini sisältää runsaasti typpeä ja se voidaan hajottaa luovuttamaan typpi muiden molekyylien, kuten DNA:n rakentamiseen. Syöpäsolujen riippuvuus glutamiinista on pitkään tunnettu potentiaalisena syövän ”Akilleen kantapäänä”.
”Solut ovat riippuvaisia glutamiinista monella tavalla”, kertoo Natasha Pavlova, biokemisti, joka tutkii syövän aineenvaihduntaa MSK:n laboratoriossa Sloan Kettering -instituutissa. ”Se ei ole vain mukana DNA-nukleotidien ja muiden molekyylien tuotannossa, vaan se vaikuttaa myös muiden aminohappojen soluun tuontiin.”
Vaikuttamalla syöpäsolujen glutamiinin saantiin syövän etenemistä voi hidastaa. Ongelma on, että terveet solut tarvitsevat myös glutamiinia. Siksi lääkkeet, jotka vaikuttavat glutamiinin pitoisuuksiin elimistössä, ovat liian vaarallisia käytettäväksi syöpähoitona.
Samalla kun tutkijat oppivat lisää siitä kuinka syöpäsolut käyttävät glutamiinia, he toivovat löytävänsä uusia tapoja kohdistaa syöpähoito syöpäsolujen erityiseen glutamiiniriippuvuuteen selektiivisesti säästämällä elimistön terveitä soluja.
Glutamiini on välttämätön ei-välttämätön aminohappo
Glutamiini on teknisesti ei-välttämätön aminohappo. Toisin kuin välttämättömät aminohapot, joita solut eivät osaa itse valmistaa ja joita meidän on saatava ravinnosta, solut voivat helposti syntetisoida glutamiinia muista lähtöaineista, kuten glutamaatista ja ammoniakista.
Glutamiinin ominaisuudet tekevät siitä ainutlaatuisen aminohapon. ”Glutamiinissa on erityistä se, että kaikki muut ei-välttämättömät aminohapot voidaan tehdä glutamiinista, mutta välttämättömät aminohapot eivät voi korvata glutamiinia”, Dr. Pavlova selittää.
Glutamiini on tärkeä useille biokemiallisille reiteille, joita syöpäsolut hyödyntävät uusien soluosien rakentamiseen. Syövän tarve glutamiinille on niin suuri, että eräät syöpää aiheuttavat onkogeenit vaikuttavat siihen, kuinka paljon solut ottavat ja tuottavat glutamiinia.
MYC-geeni, vahvistaa syöpää lisäämällä syöpäsolujen tasaista pääsyä glutamiinivarastoon. Solut, joissa on monistettu MYC-geeni, muodostavat enemmän entsyymiä, joka syntetisoi glutamiinia loppupään tuotteiksi. Tällaiset solut ovat olennaisesti riippuvaisia MYC-monistuksesta.
Natasha Pavlova kertoo, että solut ovat riippuvaisia glutamiinista monin tavoin. IDH1- ja IDH2-geenien mutaatiot, jotka muuttavat sitä, miten glutamiinituotteita käytetään solussa, ovat yleisiä tietyntyyppisissä aivosyövissä ja leukemiassa.
Korkea glutamiinin kysyntä tarkoittaa, että sen tarjonta kasvaimen sisällä on melko vähäistä. Syöpäsolut onnistuvat kuitenkin kasvamaan kasvaimen sisällä. Tämä viittaa siihen, että soluilla on vaihtoehtoisia tapoja korvata ja täydentää glutamiinitarjontaa: glukoosi. Tri Pavlovan kollegat Thompsonin laboratoriosta ja yhteistyökumppanit Princetonin yliopistosta ja New Yorkin yliopistosta (NYU) ovat havainneet, että syöpäsolut voivat ryöstää niitä ympäröivien terveiden solujen ravintoaineita omaan käyttöön.

Kohdennettu deprivaatio ja mTOR-signalointi
Rapamysiinin nisäkäskohde (mTOR) säätelee solujen lisääntymistä, autofagiaa ja apoptoosia (ohjattua solukuolemaa) osallistumalla moniin solujen signalointireitteihin.
Tutkimukset ovat osoittaneet, että mTOR-signalointireitti liittyy myös syöpään, niveltulehdukseen, insuliiniresistenssiin, osteoporoosiin ja moniin muihin sairauksiin. Tuumorissa usein aktivoituva mTOR-signalointireitti ohjaa geenien transkriptiota ja proteiinisynteesiä solujen lisääntymisen ja immuunisolujen erilaistumisen säätelemiseksi, mutta sillä on myös tärkeä rooli kasvaimen aineenvaihdunnan säätelijänä.
Ketogeeninen ruokavalio estää mTOR-reitin signalointia. mTOR, joka on fosfatidyyli-inositolikinaasiin liittyvän proteiinikinaasiperheen jäsen, on tärkeä säätelijä ravintoaineiden saatavuudessa ja keskeinen välittäjä solun kasvumekanismissa insuliinin, insuliinin kaltaisen kasvutekijä 1 (IGF 1) ja muiden kasvu-tekijäsignaaleiden välillä. mTOR-signalointireitin tukahduttaminen auttaa ymmärtämään ketogeenisen ruokavalion metabolisia ja terapeuttisia vaikutuksia.
Syöpäsolut ovat ravinnon hankinnassa hyvin sopeutumiskykyisiä. Vaikka syöpäsolujen joustavuus ravinnonlähteiden suhteen on heikko, glutamiinin rajoittaminen on äärimmäisen vaikea toteuttaa käytännösssä.
On olemassa muita mahdollisia lähestymistapoja. Yksi on estää glutamiinin tuonti tuumorisoluihin kohdentamalla lääkehoito proteiinikuljettajiin. Jotkut tutkimukset viittaavat siihen, että proteiinikuljettaja, jota kasvainsolut käyttävät glutamiinin tuontiin, eroaa normaalien solujen käyttämästä ja että tätä kuljettajaa on enemmän tuumorisoluissa. Nämä syöpäspesifiset kuljettajat voivat olla hyvä kohde lääkkeille.
Syöpäsolujen riippuvuus glutamiinista voi myös toimia perustana terapioiden räätälöimiseksi. Yksi glutamiinista riippuvainen aminohappotuote on glutationi. Tämä tärkeä antioksidantti hajottaa elimistöön päässeitä vaarallisia kemikaaleja ja reaktiivisia happilajeja (ROS).
”Glutationi voi kiinnittyä haitalliseen kemikaaliin tai molekyyliin ja ikään kuin liputtaa sen solusta poistettavaksi.
NYU:n tutkijat ovat osoittaneet, että eräät keuhkosyövän geneettiset mutaatiot ovat riippuvaisia glutationista. Glutationin häiritseminen (glutaminaasi-inhibiittoreiksi kutsuttujen lääkkeiden välityksellä) voi olla potentiaalinen keuhkosyövän hoitomenetelma. Useissa meneillään olevissa kliinisissä tutkimuksissa näitä glutamiiniin vaikuttavia lääkkeitä yhdistetään immuunipisteen estäjien ja reseptorityrosiinikinaasi-signaloinnin estäjien kanssa. Jälkimmäiset vaikuttavat solusignalointiin ja kehottavat solua hankkimaan ravintoa ja kasvamaan.
Tri Pavlova suhtautuu kuitenkin varauksella ravintoterapian hyötyihin, koska glutamiinin määrään vaikuttaminen on hyvin vaikeaa. Hän muistuttaa, että pelkkä sokereiden rajoittaminen ei syöpää paranna.
Yhteenveto tutkimuksista
Tässä tutkimuskatsauksessa seurattiin ketogeenisen ruokavalion vaikutuksia 214 syöpäpotilaaseen. Suurin osa tutkimuksista oli interventiotutkimuksia lukuun ottamatta yhtä kohorttitutkimusta. Tutkimukseen osallistuvien ikä oli enimmäkseen 50-65. Kahdeksan kymmenestä tutkimusraportista toimitettiin Euroopan maista (Saksa ja Italia) ja kaksi Yhdysvalloista.
Ketogeenisen interventiohoidon kesto vaihteli 5 päivästä 2 vuoteen, ja tulosmittaukset keskittyivät pääasiassa painoon, kehon koostumukseen ja veriprofiiliin.
Yksi raportti mitasi elämänlaatua (QOL). Raportoidut ketogeenisen ruokavalion haittavaikutukset olivat suhteellisen lieviä (ummetus, jalkakrampit, ripuli jne.).
Lyhyissä interventiotutkimuksissa ketogeenistä ruokavaliota noudattaneilla ei todettu merkittäviä muutoksia tutkimusmarkkereissa, kuten painossa ja veren lipidiprofiilissa lukuun ottamatta laktaattipitoisuuden vähenemistä kasvainkudoksessa. (2 weeks in the study by Rossi-Fanelli et al.,(12); 1 week in the study by Fearon et al. (11); 5 days in the study by Schroeder et al.(16)).
Ketogeenisen ruokavalion pidempi noudattaminen; 8 viikkoa, ketogeeninen ruokavalio (normaali ateria + rasvaa sisältävä nestemäinen ruokavalio) vaikutti positiivisesti potilaiden energisyyteen ja painoon (13). Ketogeenistä ruokavaliota käytettiin tutkimuksessa esimerkiksi aliravituilla maha-suolikanavan syöpäpotilailla, joille oli kehittynyt syövän etäpesäkkeitä.
Syöpälääkkeiden biomarkkereiden arviointia ei mitattu useimmissa artikkeleissa lukuun ottamatta Jansenin ja Walachin tutkimusta (18); siinä havaittiin, että TKTL1, eli kasvaimen etenemiseen liittyvä markkeri väheni 2 vuoden ketogeenisellä ruokavaliolla.
Erityisesti Fine et al. ., (15) Rieger et al., (17) sekä Klement ja Sweeney (19) osoittivat, että ketoniruokavalio vaikutti merkittävästi painon laskuun. Nämä tulokset osoittivat, että toisin kuin johdonmukaiset ketogeeniset vaikutukset epilepsiapotilailla, ketogeeniset vaikutukset syöpäpotilailla eivät olleet johdonmukaisia tässä katsauksessa.
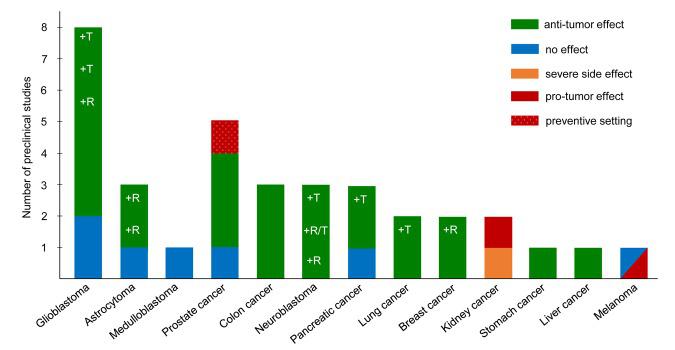
Ketogeenisen ruokavalion vaikutus eri syöpätyyppeihin
KETOGEENINEN RUOKAVALIO TERAPEUTTISENA STRATEGIANA
Viime aikoina ketogeeninen ruokavalio on nostettu vaihtoehdoksi syövän hoidossa sekä ihmisillä ja syöpähoitojen eläinmalleissa. Jotkut prekliinisistä tutkimuksista ovat osoittaneet ketogeenisen ruokavalion vähentävän kasvaimen kasvua ja parantavan selviytymistä pahanlaatuisen gliooman (21–23), eturauhassyövän (24–26), paksusuolisyövän (27) ja maha-suolikanavan syövän eläinmalleissa (28).
Vähäkalorinen ruokavalio, kuten paaston indusoima ketoositila tehostaa syöpäsolujen reaktiota kemoterapiaan ja parantaa joitain kemoterapian aiheuttamia sivuvaikutuksia normaaleissa kudoksissa (29).
Viime aikoina on julkaistu useita tapausraportteja. Ensimmäinen raportti saatiin vahvistetusta glioblastooman multiformista, jota hoidettiin tavanomaisella hoidolla yhdessä rajoitetun ketogeenisen ruokavalion kanssa; tapauksessa havaittu vaste viittasi kalorirajoitetun ketogeenisen ruokavalion potentiaalisiin hyötyihin (30).
Ketogeenistä ruokavaliota on tutkittu intensiivisesti Euroopan maassa, kuten Saksassa. Näissä tutkimuksissa potilaan fyysistä olotilaa parannettiin onnistuneesti. Kasvaimet kutistuivat ketogeenisellä ruokavaliolla (14).
Tässä käsitellyistä tutkimuksista puuttuu syöpätyypin, syövän sijainnin, syövän vaiheiden ja syövän hoidon kulku, joten tuloksia ei voida yleistää.
Ketogeeninen ruokavalio johtaa yleensä lisääntyneeseen laihtumiseen. Sairaalloinen laihtuminen aiheuttaa syöpäpotilaiden kohdalla huolta, mutta tässä katsauksessa havaitsimme, että ketogeenisellä ruokavaliolla ei ollut merkittäviä haitallisia vaikutuksia. Se voi johtua siitä, että tutkittavat olivat aikuisia, kun taas lasten pitkäaikainen ketogeeninen ruokavalio voi aiheuttaa munuaisvaurioita, kuten munuaiskiviä (31). Tässä katsauksessa ilmoitetut haittavaikutukset olivat ummetus, ripuli, uupumus jne.
Terveillä lihavilla aikuisilla, hiilihydraatteja rajoittavan ruokavalion ilmoitetut haittavaikutukset kuuden kuukauden jälkeen olivat matalatiheyksisen lipoproteiinikolesterolin (LDL) tason nousu ja jonkin verran vapinaa ja levottomuutta (32).
Tässä katsauksessa kuvatuissa tutkimuksissa arvioitiin ketogeenisen ruokavalion vaikutuksia syöpäpotilailla. Ainoastaan kymmenen tutkimusta analysoitiin, ja ominaisuudet ja tutkimuksen suunnittelu, ketogeeninen ruokavalio, tutkimuksen pituus, syöpätyyppi ja -vaihe sekä kasvainten sijainti olivat heterogeenisiä, mikä osaltaan johti puutteellisiin johtopäätöksiin. Tällä hetkellä on käynnissä ainakin 62 ketogeenisen ruokavalion vaikutuksia syöpään selvittävää tutkimusta.
Näistä 13 tutkimuksessa arvioidaan ketogeenistä ruokavaliota syöpähoitoa tehostavana terapiana.
Loppupäätelmiä ja ajatuksia
Katsauksen tavoite oli arvioida ketogeenisen ruokavalion toteutettavuutta ja soveltuvuutta syöpäterapiana sekä arvioida muuttujia, kuten vartalon koostumus, veriprofiilit ja QOL. Tämän tarkastelun perusteella saatiin lisää näyttöä siitä, että ketogeeninen ruokavalio on syöpäpotilailla turvallinen ja hyvin siedetty syöpähoitoja tehostava terapiavaihtoehto.
Jotta luotettavia päätelmiä ketogeenisen ruokavalion vaikutuksista syövän etenemiseen voidaan tehdä tarvitaan kuitenkin uusia pitkäkestoisia ruokavaliointerventioita, joissa huomioidaan syöpään liittyviä muuttujia ja biomarkkereita laajemmalti.
Johtopäätöksenä on, että ketoniruokavalion tehokkuus ja siedettävyys voi olla parempi eräissä syöpätyypeissä (parempi glioblastoomassa kuin mahasyövässä) .Ketogeenistä ruokavaliota voidaan käyttää turvallisesti syöpäpotilailla, jos sitä seurataan huolellisesti. On tärkeää luoda standardoitu ketogeeniseen ruokavalioon perustuva hoitoprotokolla.
Ketogeenisen ruokavalion arvellaan olevan tehokas syöpäterapia. Pelkästään ketogeenisen ruokavalion vaikutukset vaihtelevat syövän tyypistä riippuen, mutta ketogeenisen ruokavalion ja kemoterapian tai sädehoidon yhteisvaikutus on lupaava.
Toisaalta syöpäpotilaiden ketogeenisen ruokavalion kliinisten tutkimusten tulokset olivat kiistanalaisia. Tämä johtuu siitä, että tiukkoja ruokavalion rajoituksia, esimerkiksi ketonisuhdetta 2: 1 – 4: 1, ei voida jatkaa aikuisilla syöpäpotilailla.
Jos hiilihydraattirajoitus on riittämätön, esimerkiksi glukoosirajoitus 50–70 g:aan päivässä, seerumin ketoaineet eivät indusoidu kokonaan ja kasvainten vastainen vaikutus on epäselvä. Lisäksi ei ole selvää, kuinka kauan potilaiden on jatkettava ketogeenistä ruokavaliota kasvaimen vastaisen vaikutuksen osoittamiseksi.
Ketogeenisen ruokavalion kliinistä vaikutusta syöpäpotilailla on arvioitu myös käyttämällä PET-CT:tä ja pitkäaikaisia havaintoja. Nykyisellä ketogeenisellä ruokavaliohoidolla näyttää olevan myönteinen vaikutus pitkälle edenneiden syöpäpotilaiden elinajan odotteeseen.
Ketogeenisestä ruokavaliosta saadaan jatkuvasti uutta tietoa. Se vaikuttaa monimutkaisesti aineenvaihduntaan ja solujen signalointireitteihin. On useita mekanismeja, joilla KD voi hillitä syövän etenemistä. Tutkimusten valossa KD näyttää tehostavan kemoterapian ja sädehoidon vaikutuksia ja lisäävän pitkälle edenneitä syöpiä sairastaneiden elinajan odotetta. Tämä hieman laajennettu tutkimuskatsaus on vain pintaraapaisu, joka tarjoaa monimutkaisesta asiasta yksinkertaistetun kuvan.
Tutkimuksia ja lähdeaineisto
https://www.mdpi.com/2072-6643/12/5/1473/htm
https://clincancerres.aacrjournals.org/content/19/14/3905.full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5842847/
https://meridian.allenpress.com/radiation-research/article-abstract/187/6/743/150766
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5624453/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5842847/
https://www.sciencedirect.com/science/article/pii/S2213231714000925
https://www.mskcc.org/news/beyond-sugar-what-cancer-cells-need-grow
https://stm.sciencemag.org/content/12/547/eabc8942
https://cellandbioscience.biomedcentral.com/articles/10.1186/s13578-020-00396-1
1. Demark-Wahnefried W, Morey MC, Sloane R, Snyder DC, Cohen HJ. Promoting healthy lifestyles in older cancer survivors to improve health and preserve function. J Am Geriatr Soc 2009;57 Suppl 2:S262–4.10.1111/j.1532-5415.2009.02507.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2. Kushi LH, Kwan ML, Lee MM, Ambrosone CB. Lifestyle factors and survival in women with breast cancer. J Nutr 2007;137: 236S–42S. [PubMed] [Google Scholar]
3. Patterson RE, Cadmus LA, Emond JA, Pierce JP. Physical activity, diet, adiposity and female breast cancer prognosis: a review of the epidemiologic literature. Maturitas 2010;66:5–15.10.1016/j.maturitas.2010.01.004 [PubMed] [CrossRef] [Google Scholar]
4. Imoberdorf R, Rühlin M, Ballmer PE. Cancer and nutrition: a paradigma shift. Laryngorhinootologie 2017;96:514–8. [PubMed] [Google Scholar]
5. Wei M, Brandhorst S, Shelehchi M, Mirzaei H, Cheng CW, Budniak J, et al. Fasting-mimicking diet and markers/risk factors for aging, diabetes, cancer, and cardiovascular disease. Sci Transl Med 2017;9:eaai8700.10.1126/scitranslmed.aai8700 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
6. Champ CE, Baserga R, Mishra MV, Jin L, Sotgia F, Lisanti MP, et al. Nutrient restriction and radiation therapy for cancer treatment: when less is more. Oncologist 2013;18:97–103.10.1634/theoncologist.2012-0164 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Bonkowski MS, Dominici FP, Arum O, Rocha JS, Al Regaiey KA, Westbrook R, et al. Disruption of growth hormone receptor prevents calorie restriction from improving insulin action and longevity. PLoS One 2009;4:e4567.10.1371/journal.pone.0004567 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 2009;324:1029–33.10.1126/science.1160809 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9. Huebner J, Marienfeld S, Abbenhardt C, Ulrich C, Muenstedt K, Micke O, et al. Counseling patients on cancer diets: a review of the literature and recommendations for clinical practice. Anti-cancer Res 2014;34:39–48. [PubMed] [Google Scholar]
10. Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions version 5.1.0. http://handbook.cochrane.org. [updated March 2011].
11. Fearon KC, Borland W, Preston T, Tisdale MJ, Shenkin A, Calman KC. Cancer cachexia: influence of systemic ketosis on substrate levels and nitrogen metabolism. Am J Clin Nutr 1988;47:42–8. [PubMed] [Google Scholar]
12. Rossi-Fanelli F, Franchi F, Mulieri M, Cangiano C, Cascino A, Ceci F, et al. Effect of energy substrate manipulation on tumour cell proliferation in parenterally fed cancer patients. Clin Nutr 1991;10:228–32.10.1016/0261-5614(91)90043-C [PubMed] [CrossRef] [Google Scholar]
13. Breitkreutz R, Tesdal K, Jentschura D, Haas O, Leweling H, Holm E. Effects of a high-fat diet on body composition in cancer patients receiving chemotherapy: a randomized controlled study. Wien Klin Wochenschr 2005;117:685–92.10.1007/s00508-005-0455-3 [PubMed] [CrossRef] [Google Scholar]
14. Schmidt M, Pfetzer N, Schwab M, Strauss I, Kämmerer U. Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: a pilot trial. Nutr Metab (Lond) 2011;8:54.10.1186/1743-7075-8-54 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
15. Fine EJ, Segal-Isaacson CJ, Feinman RD, Herszkopf S, Romano MC, Tomuta N, et al. Targeting insulin inhibition as a metabolic therapy in advanced cancer: a pilot safety and feasibility dietary trial in 10 patients. Nutrition 2012;28:1028–35.10.1016/j.nut.2012.05.001 [PubMed] [CrossRef] [Google Scholar]
16. Schroeder U, Himpe B, Pries R, Vonthein R, Nitsch S, Wollenberg B. Decline of lactate in tumor tissue after ketogenic diet: in vivo microdialysis study in patients with head and neck cancer. Nutr Cancer 2013;65:843–9.10.1080/01635581.2013.804579 [PubMed] [CrossRef] [Google Scholar]
17. Rieger J, Bähr O, Maurer GD, Hattingen E, Franz K, Brucker D, et al. ERGO: a pilot study of ketogenic diet in recurrent glioblastoma. Int J Oncol 2014;44:1843–52.10.3892/ijo.2014.2382 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Jansen N, Walach H. The development of tumours under a ketogenic diet in association with the novel tumour marker TKTL1: a case series in general practice. Oncol Lett 2016;11:584–92. [PMC free article] [PubMed] [Google Scholar]
19. Klement RJ, Sweeney RA. Impact of a ketogenic diet intervention during radiotherapy on body composition: I. Initial clinical experience with six prospectively studied patients. BMC Res Notes 2016;9:143.10.1186/s13104-016-1959-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Tan-Shalaby JL, Carrick J, Edinger K, Genovese D, Liman AD, Passero VA, et al. Modified Atkins diet in advanced malignancies – final results of a safety and feasibility trial within the Veterans Affairs Pittsburgh Healthcare System. Nutr Metab (Lond) 2016;13:52.10.1186/s12986-016-0113-y [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Maurer GD, Brucker DP, Bähr O, Harter PN, Hattingen E, Walenta S, et al. Differential utilization of ketone bodies by neurons and glioma cell lines: a rationale for ketogenic diet as experimental glioma therapy. BMC Cancer 2011;11:315.10.1186/1471-2407-11-315 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Seyfried TN, Sanderson TM, El-Abbadi MM, McGowan R, Mukherjee P. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer. Br J Cancer 2003;89: 1375–82.10.1038/sj.bjc.6601269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
23. Stafford P, Abdelwahab MG, Kim DY, Preul MC, Rho JM, Scheck AC. The ketogenic diet reverses gene expression patterns and reduces reactive oxygen species levels when used as an adjuvant therapy for glioma. Nutr Metab (Lond) 2010;7:74.10.1186/1743-7075-7-74 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Freedland SJ, Mavropoulos J, Wang A, Darshan M, Demark-Wahnefried W, Aronson WJ, et al. Carbohydrate restriction, prostate cancer growth, and the insulin-like growth factor axis. Prostate 2008;68:11–9.10.1002/pros.20683 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Masko EM, Thomas JA, 2nd, Antonelli JA, Lloyd JC, Phillips TE, Poulton SH, et al. Low-carbohydrate diets and prostate cancer: how low is “low enough”? Cancer Prev Res (Phila) 2010;3:1124–31.10.1158/1940-6207.CAPR-10-0071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26. Mavropoulos JC, Buschemeyer WC, 3rd, Tewari AK, Rokhfeld D, Pollak M, Zhao Y, et al. The effects of varying dietary carbohydrate and fat content on survival in a murine LNCaP prostate cancer xenograft model. Cancer Prev Res (Phila) 2009;2:557–65.10.1158/1940-6207.CAPR-08-0188 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Beck SA, Tisdale MJ. Nitrogen excretion in cancer cachexia and its modification by a high fat diet in mice. Cancer Res 1989;49:3800–4. [PubMed] [Google Scholar]
28. Otto C, Kaemmerer U, Illert B, Muehling B, Pfetzer N, Wittig R, et al. Growth of human gastric cancer cells in nude mice is delayed by a ketogenic diet supplemented with omega-3 fatty acids and medium-chain triglycerides. BMC Cancer 2008;8:122.10.1186/1471-2407-8-122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
29. Lee C, Raffaghello L, Brandhorst S, Safdie FM, Bianchi G, Martin-Montalvo A, et al. Fasting cycles retard growth of tumors and sensitize a range of cancer cell types to chemotherapy. Sci Transl Med 2012;4:124ra27.10.1126/scitranslmed.3003293 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Zuccoli G, Marcello N, Pisanello A, Servadei F, Vaccaro S, Mukherjee P, et al. Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: case report. Nutr Metab (Lond) 2010;7:33.10.1186/1743-7075-7-33 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. McNally MA, Pyzik PL, Rubenstein JE, Hamdy RF, Kossoff EH. Empiric use of potassium citrate reduces kidney-stone incidence with the ketogenic diet. Pediatrics 2009;124:e300–4.10.1542/peds.2009-0217 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
32. Yancy WS, Jr, Olsen MK, Guyton JR, Bakst RP, Westman EC. A low-carbohydrate, ketogenic diet versus a low-fat diet to treat obesity and hyperlipidemia: a randomized, controlled trial. Ann Intern Med 2004;140:769–77.10.7326/0003-4819-140-10-200405180-00006 [PubMed] [CrossRef] [Google Scholar]
Articles from Journal of Cancer Prevention are provided here courtesy of Korean Society of Cancer Prevention